純堿(蘇打)是如何生產出來的
純堿,又名蘇打,學名為碳酸鈉,化學式為Na2CO3,是一種非常重要的化工原料,廣泛應用于制造玻璃、冶煉金屬、印染、洗滌等方面。那么純堿是怎么制備出來的?想知道純堿的制備工藝嗎?

制備純堿最為著名的技術有兩種。一種是氨堿法制純堿,由比利時人索爾維研制,又名索氏制堿法,另一種是聯合制堿法,由我國的侯德榜先生研制,又名侯氏制堿法。
這兩項技術原理相同,總反應方程式為:
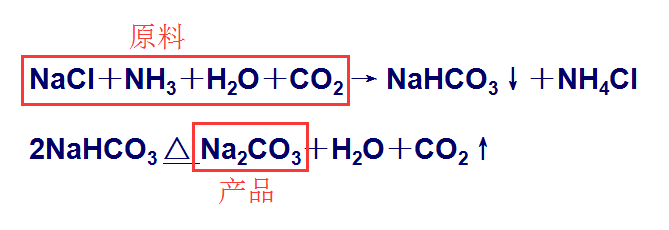
從原理反應中,可以看到,反應原料有四種,分別是NaCl、NH3、H2O 和 CO2 。但兩項技術的原料獲取方式不同。
氨堿法
原料鹽(NaCl)和水,可以直接獲取。
原料CO2 來源于是煅燒石灰石。
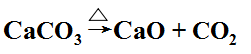
產生的CaO可以用來回收NH4+ (NH4Cl),實現NH3的循環使用。
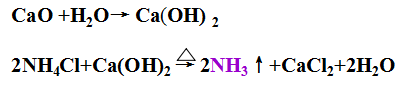
原料氨可以循環利用。 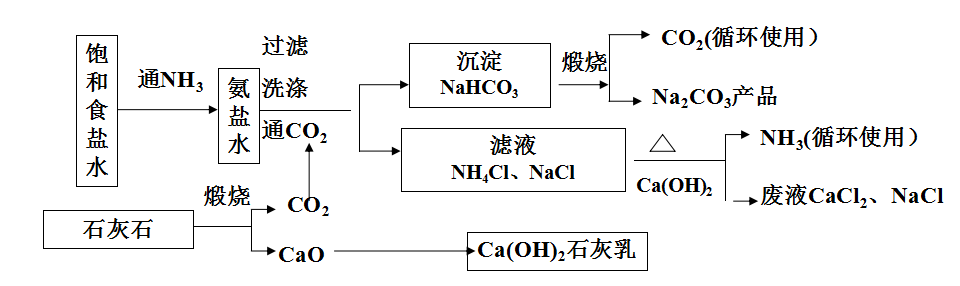
優點:
1、原料石灰石、鹽(NaCl)、水,價格便宜,易于獲取。
2、另一原料氨,可以循環利用,損傷較少。
3、能夠大規模連續生產,易于機械化,自動化,可得到較高質量的純堿。
缺點:
1、原料利用率低,造成大量含有Cl-的廢液排出,嚴重污染環境。
2、蒸餾以回收氨,需設置蒸氨塔,消耗大量的蒸汽和石灰,從而造成流程長,設備龐大和能量上的浪費。
工藝主要過程
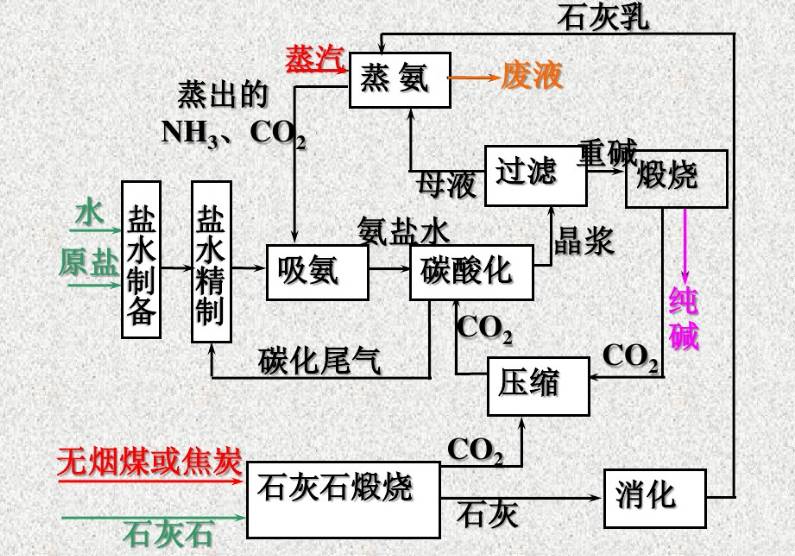
1、CO2 氣體和石灰乳的制備。煅燒石灰石制得石灰和二氧化碳,將石灰入水得石灰乳。
2、鹽水的制備、精制及氨化,制氨鹽水。
3、氨鹽水的碳酸化制重堿。來自石灰石煅燒及重堿煅燒的CO2,經壓縮、冷卻送至碳化塔。
4、重堿的過濾及洗滌(即碳化所得晶漿的液固分離)。
5、重堿煅燒制得純堿成品及CO2。
6、母液中氨的蒸餾回收。
下面為大家詳細介紹。
1,石灰石煅燒與制備石灰乳
石灰窯圖解
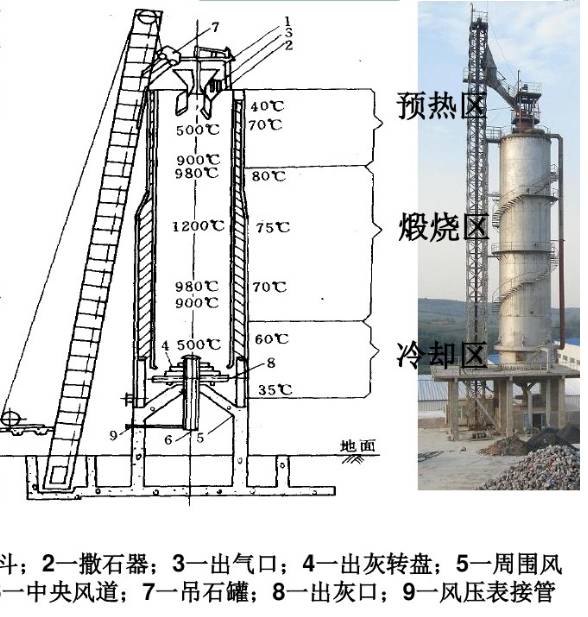
CO2是由煅燒石灰石得到的,反應簡單但工業過程并不容易。
生產上為了保證反應速度,溫度比計算的略高,窯內溫度范圍940-1200°C。溫度太高,可能結疤影響生產正常進行,或生成“過燒石灰”也不利。
煅燒石灰石得到的CaO先與水反應生成氫氧化鈣。實際生產中氫氧化鈣是過飽和的,是溶液與未溶解固體的混合物,稱為石灰乳。要求石灰乳較稠為好,這樣對蒸氨過程有利。但太稠了粘度大,易堵塞管道。其在水中溶解度很低,且隨溫度升高而降低。
2,飽和食鹽水制備和精制
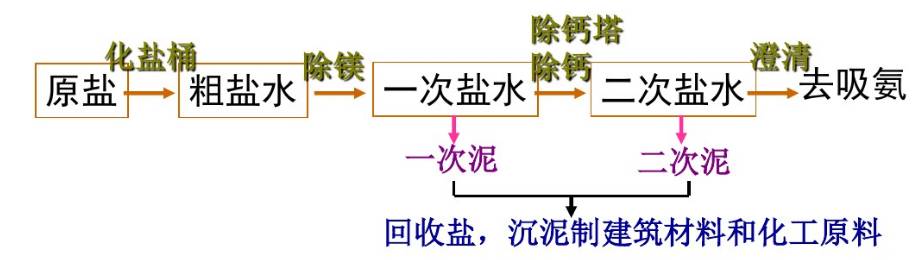
目的: 是將粗鹽中所含雜質如Ca鹽和Mg鹽等除去,因為在吸收氨和碳酸化過程中,可能生成氫氧化鎂和碳酸鈣沉淀,使管道堵塞或影響產品質量。
方法: 先加入石灰乳使鎂離子變成鈣離子:
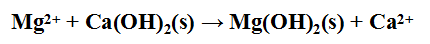
除鈣可用下列兩法之一:
A(石灰塔氣法 )和B(石灰純堿法)
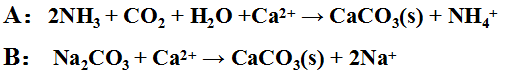
3,鹽水吸氨制氨鹽水
吸氨過程的主要反應為:
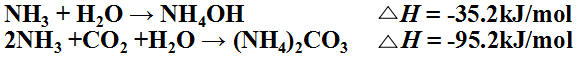
反應放熱較多,每千克氨吸收成氨鹽水可放熱4280kJ。如不及時移走,可使系統溫度升高到90℃以上 。溫度升高,氨分壓增加,對吸收過程是不利的。所以要用多個塔外水冷器冷卻。使塔中部溫度為60 ℃ ,底部為30 ℃。 副反應有與鈣鎂離子反應生成沉淀的反應。
吸氨的主要設備是吸氨塔。氨從中部引入,引入處反應劇烈,溫升大,所以部分吸氨液循環冷卻后繼續。上部各段都有溶液冷卻循環以保證塔內溫度。澄清桶的目的是除去少量鈣鎂鹽沉淀,達到雜質含量少于0.1kg/m-3的標準。操作壓力略低于大氣壓,減少氨損失和循環氨引入。
4,氨鹽水的碳酸化
碳酸化過程分為三步:氨鹽水先與CO2反應生成氨基甲酸銨,然后再水解生成碳酸氫銨,再與鈉離子反應生成碳酸氫鈉。
氨鹽水碳酸化反應是放熱反應,放熱量不大,但是要注意冷卻才能保證反應正常進行。
氨鹽水進塔溫度約30~50 ℃,塔中部溫度升到60 ℃左右,中部不冷卻,但下部要冷卻,控制塔底溫度在30 ℃以下,保證結晶析出。
溫度條件中注意碳化塔中部溫度高些。其原因是一方面反應本身有一些熱量放出,另一方面主要是考慮結晶初期溫度高一點對晶粒長大有利,可形成較大晶體以利過濾。同時冷卻速度不宜過快,過快可能形成結晶漿,難于過濾分離。
生產中要注意清洗堵塞的結晶及雜質沉淀。往往一塔生產,另一塔清洗。用新鮮氨鹽水和CO2使結晶生成碳酸鹽溶解除去。
5,氨的回收
氨堿法生產純堿時,氨是循環利用的。因此要將母液中的氨鹽分解以回收氨。此過程稱為蒸氨過程。
實際操作過程中還應注意加熱段與石灰乳蒸餾段連接處。因加熱后液體基本無游離氨,平衡氨分壓接近零。而下部來的氣體氨含量高,所以有部分氨反而要溶于液體中,加熱段并不能完全將游離氨除凈。
6,重質純堿的制造
過濾:分離晶漿中懸浮的固相NaHCO3 (45~50%),在過濾 的同時進行洗滌,把重堿中殘留的母液洗去,并進行脫水,使重堿含水量降低。
所得到的粗重堿的組分一般為下圖所示:

煅燒后,首先驅出游離水分,然后進行碳酸氫銨和碳酸氫鈉的分解,獲得產品NaCO3。
重堿煅燒反應方程式: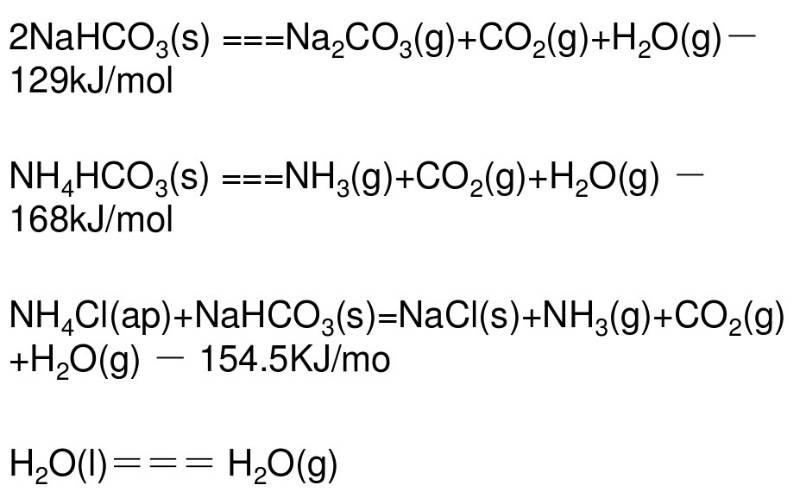
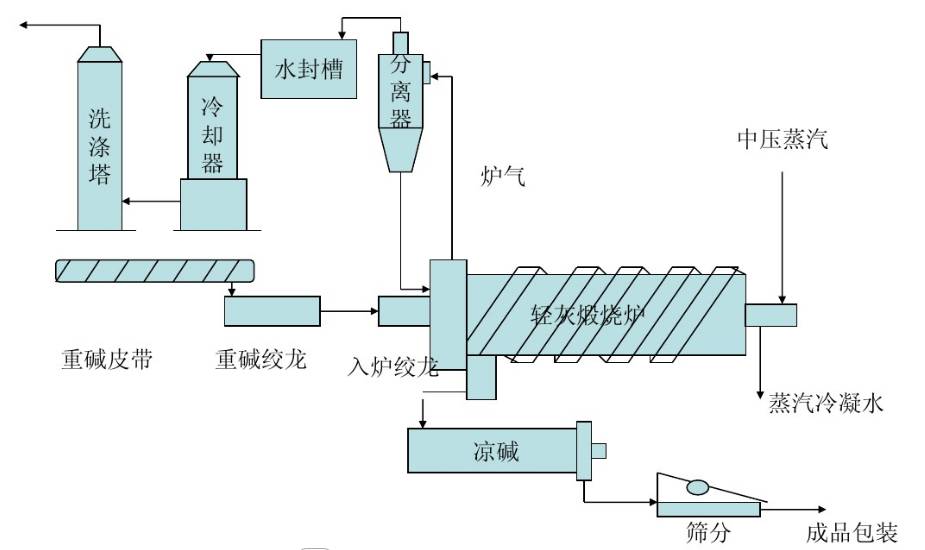
重堿煅燒的工藝流程
| 上一條信息:工業鍋爐常識,看典型... | 下一條信息:十幾個省市對化工企業... | 返回列表 |